トップページ > 臨床研究安全管理室
臨床研究安全管理室
更新日:2024年4月11日
連絡先
SAEreport"AT"hosp.ncgm.go.jp ※"AT"を@に変えてください業務
臨床研究安全管理室では、NCGMにおいて臨床研究を実施するにあたり生じた逸脱、有害事象、不正または不正につながりかねない状況などを把握し、研究の適正性、信頼性、倫理的妥当性、科学的合理性などを検討しています。また、臨床研究における安全性報告手続きなどについて、研究者を支援します。
臨床研究における安全性報告
以下の事項が発生した場合、報告対象と報告期限を確認の上、必要な報告書をダウンロードして、上記連絡先まで提出してください。認定臨床研究審査委員会(CRB)への報告義務のある事象については定められた統一書式を使用し、それ以外はNCGM様式を使用してください。
【人を対象とする医学系研究に関する倫理指針】
有害事象 :実施された研究との因果関係の有無を問わず、研究対象者に生じた全ての好ましくない又は意図しない傷病若しくはその徴候、臨床検査値の異常を含む。
重篤な有害事象:有害事象のうち、次に掲げるいずれかに該当するものをいう。
①死に至るもの
②生命を脅かすもの
③治療のための入院又は入院期間の延長が必要となるもの
④永続的又は顕著な障害・機能不全に陥るもの
⑤子孫に先天異常を来すもの
不適合 :人を対象とする医学系研究に関する倫理指針、研究計画書、手順書等の不遵守及び研究データの改ざん、ねつ造等をいう。
【臨床研究法・関連通知等】
疾病等 : 有害事象のうち、特定臨床研究の実施に起因するものと疑われる疾病、障害若しくは死亡又は感染症に加え臨床検査値の異常や諸症状を含む。
感染症 : 生物由来製品において、生物由来の原料又は材料から、当該医薬品等への病原体の混入が疑われる場合等を指すこと。また、HBV、HCV、HIV等のウイルスマーカーの陽性化についても、感染症報告の対象となる。
不具合 : 医療機器の破損や作動不良、再生医療等製品の機能不全、細胞が人体に及ぼす副作用等をいう。
不適合 : 臨床研究法施行規則、研究計画書、手順書等の不遵守及び研究データの改ざん、ねつ造等をいう。
重大な不適合:臨床研究の対象者の人権や安全性及び研究の進捗や結果の信頼性に影響を及ぼすものをいう。例えば、選択・除外基準や中止基準、併用禁止療法等の不遵守をいい、臨床研究の対象者の緊急の危険を回避するためその他医療上やむを得ない理由により研究計画書に従わなかったものについては含まない。
報告の主な流れの例
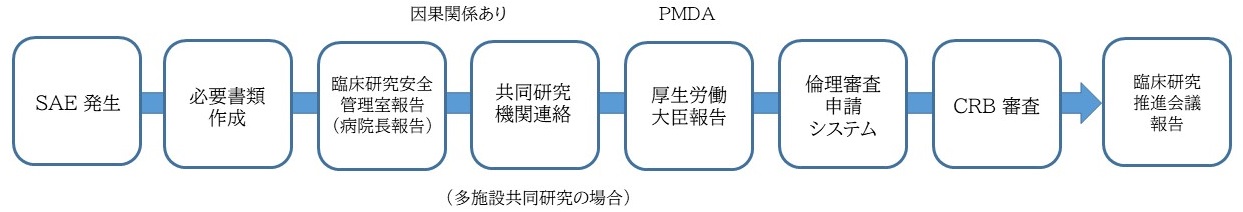
1.重篤な有害事象 (Serious Adverse Event:SAE)が発生した場合
統一書式
重篤な有害事象のうち、特定臨床研究等(臨床研究法順守)において、CRBへ報告義務のある疾病等/不具合が生じた場合は、以下の報告期限に留意して、該当する統一書式を使用して報告して下さい。NCGM様式
CRBへの報告義務のない事象については、以下のNCGM書式をご使用ください。(例:医学系指針に準拠した研究で生じたSAE、特定臨床研究等においてNCGMで生じたSAE等)
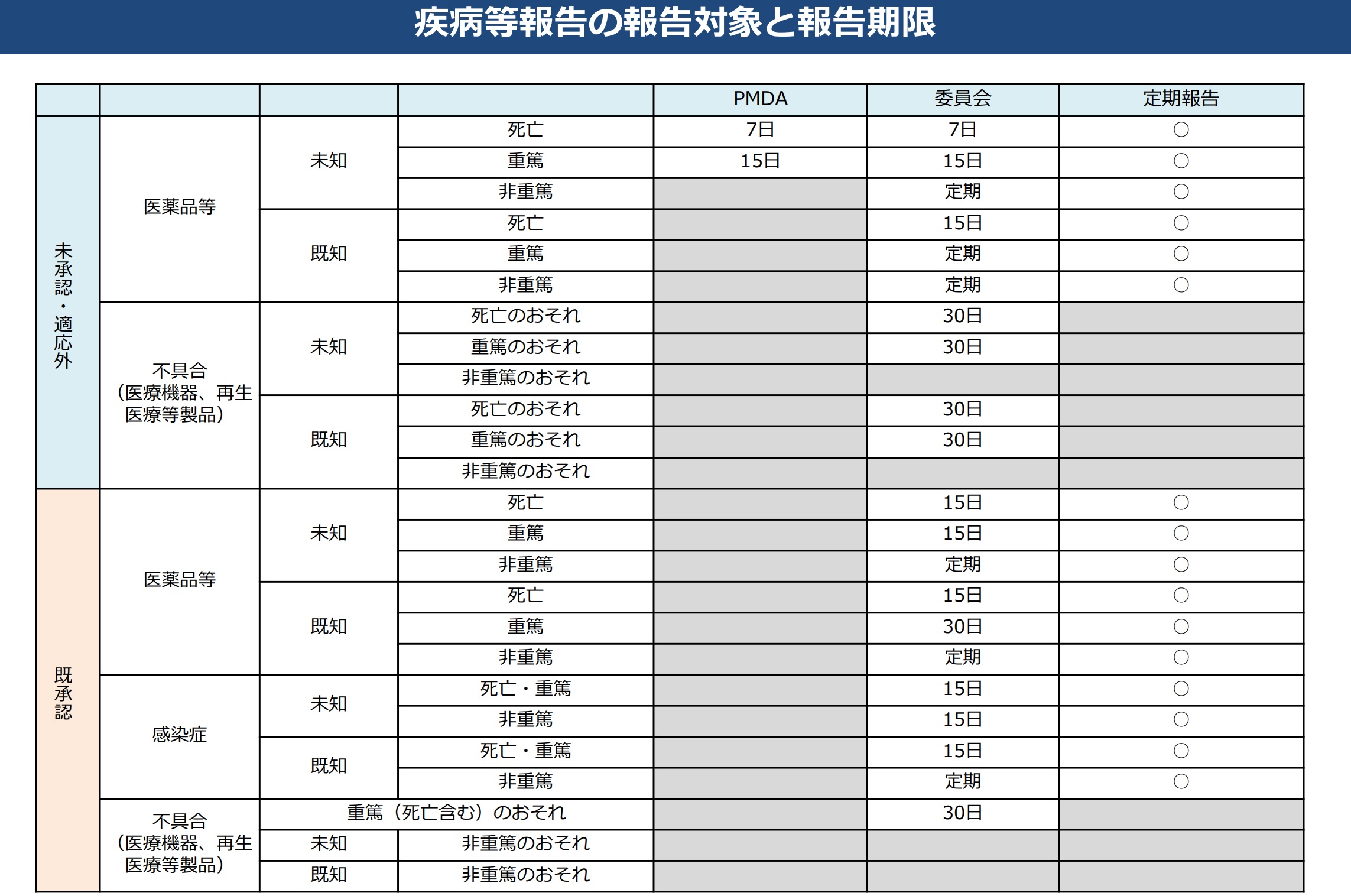
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000163417.html
上記を加工して作成
上記事象のうち、厚生労働大臣(医薬品医療機器総合機構:PMDA)への疾病等報告を要するものは、jRCT(臨床研究実施計画・研究概要公開システム)の疾病等報告システムより報告して下さい。
※報告内容登録後、「PMDA にメール送信」ボタン押下時に、入力内容が自動的に厚生労働大臣(PMDA)に送信されます。