モニタリング
詳細は院内専用sharepointを参照してください。
≪院内専用Sharepoint≫
NCGM share point > 研究関係 > お知らせ_倫理審査関係(CRB, 倫理審査委員会) > ◆各申請方法リンク_NCGMもしくは他の認定臨床研究審査委員会(CRB)にて審査 > ■臨床研究開始後_モニタリング・監査
【モニタリングの基本的な流れ】
研究責任医師は、基本的に下記の1~3の流れでモニタリングを実施します。
1. モニタリング手順書・モニタリング計画書を作成する
研究責任医師は、モニタリング手順書(必須)・モニタリング計画書(必要に応じて)を作成します。モニタリング手順書の様式は院内専用Sharepointからご確認ください。作成にあたり、モニタリング担当者として指名予定の方と協議し、被験者の安全の保持及び人権の保護並びに研究の信頼性確保を考慮した実現可能なモニタリングプランを作成してください。
<多施設共同研究での留意点>
多施設共同研究でNCGMが従施設として臨床研究を実施する場合、モニタリング手順書/計画書の作成は主施設の研究責任医師の業務です。
2. モニタリング担当者を指名する
認定臨床研究審査委員会にてモニタリング手順書が承認された後、研究責任医師は、モニタリング担当者の要件を満たした者を、モニタリング担当者指名書(モニタリング手順書雛形_別添様式2)にて指名します。
<多施設共同研究での留意点>
多施設共同研究でNCGMが従施設として臨床研究を実施する場合、モニタリング担当者指名書の作成は主施設の研究責任医師の業務です。
3. 手順書・計画書に基づき、モニタリングを実施
研究責任医師は、モニタリング担当者に指示しモニタリングを実施させます。モニタリング実施後、モニタリング担当者は研究責任医師宛にモニタリング報告書(モニタリング手順書雛形_別添様式1)を提出します。研究責任医師によるモニタリング報告書の内容の承認後、モニタリング終了となります。
モニタリング担当者は、モニタリング報告書を研究責任医師に提出するとともに、モニタリング主幹部署:臨床研究センター臨床研究推進部にも提出してください。詳細は、院内専用Sharepointの「国立研究開発法人国立国際医療研究センターモニタリングの実施に関する手順書」を参照してください。
【モニタリング実施に関する手続きについて】
1. NCGMに所属する者がモニターとしてモニタリングを実施する場合
• NCGMに所属する者がモニタリングを実施する場合、事前に院内専用Sharepointから講習を受講してください。
• 実施に関する手続き等はございません。自科の電子カルテを使用する際は、被験者のプライバシーが守られる場所(鍵のついた個室など)で実施するよう細心の注意を払ってください。
2. NCGMに所属しない外部のモニターがモニタリングを実施する場合
下記リンクをご参照ください。
直接閲覧受付窓口|臨床研究センター (ncgm.go.jp)
【モニタリング支援キット】
モニタリング初心者の方を対象に、モニタリングの流れを分かりやすく説明し業務を補助する資料を作成しています。
モニタリング支援キットは院内専用Shrepointから各自ダウンロードしてご活用ください。
【モニタリングに関するご相談】
臨床研究相談で受け付けています。
院内専用Share Pointの研究関係_臨床研究相談に相談事項を入力してください。
臨床研究の監査
【一般的な監査の流れ】
1.監査の要否を判断する(研究責任者)
ア) 判断基準
イ) NCGMでの例示
2.監査計画書及び監査手順書を作成する(研究責任者)
ア) 監査計画書の様式と留意事項(監査手順書 様式1)
イ) 監査手順書と留意事項
3.監査担当者を指名する(研究責任者)
ア) 監査担当者の要件
イ) 指名書の様式(監査手順書 様式4)
4.監査の種類及び監査のタイミング
ア) 監査の種類
イ) 監査のタイミング
5.監査を実施する(監査担当者/研究責任者・各部署の担当者)
(1)事前準備をする(監査担当者) 事前準備の内容
(2)各部署の担当者に連絡する(監査担当者) 監査対象となる部署
(3)監査のための資料を準備する(各分野担当者) 監査対象となる資料
(4)監査の実施
① 監査を実施する
② 監査記録、監査報告書を作成する(監査担当者)
③ 監査報告書を研究責任者及び実施医療機関の長及び/又は管理者に提出する
監査報告書の様式と留意事項(監査手順書 様式2)
④ 研究責任者は回答書を作成し、監査担当者に回答する
回答書の様式と留意事項(監査手順書 様式5)
⑤ 監査担当者は回答書が了解出来たら確認書を研究責任者に提出する
回答確認書の様式と留意事項(監査手順書 様式6))
⑥ すべての監査が終了したときは、監査証明書を研究責任者及び実施医療機関の長及び/又は管理者に提出する
監査証明書の様式(監査手順書 様式3)
【説明】
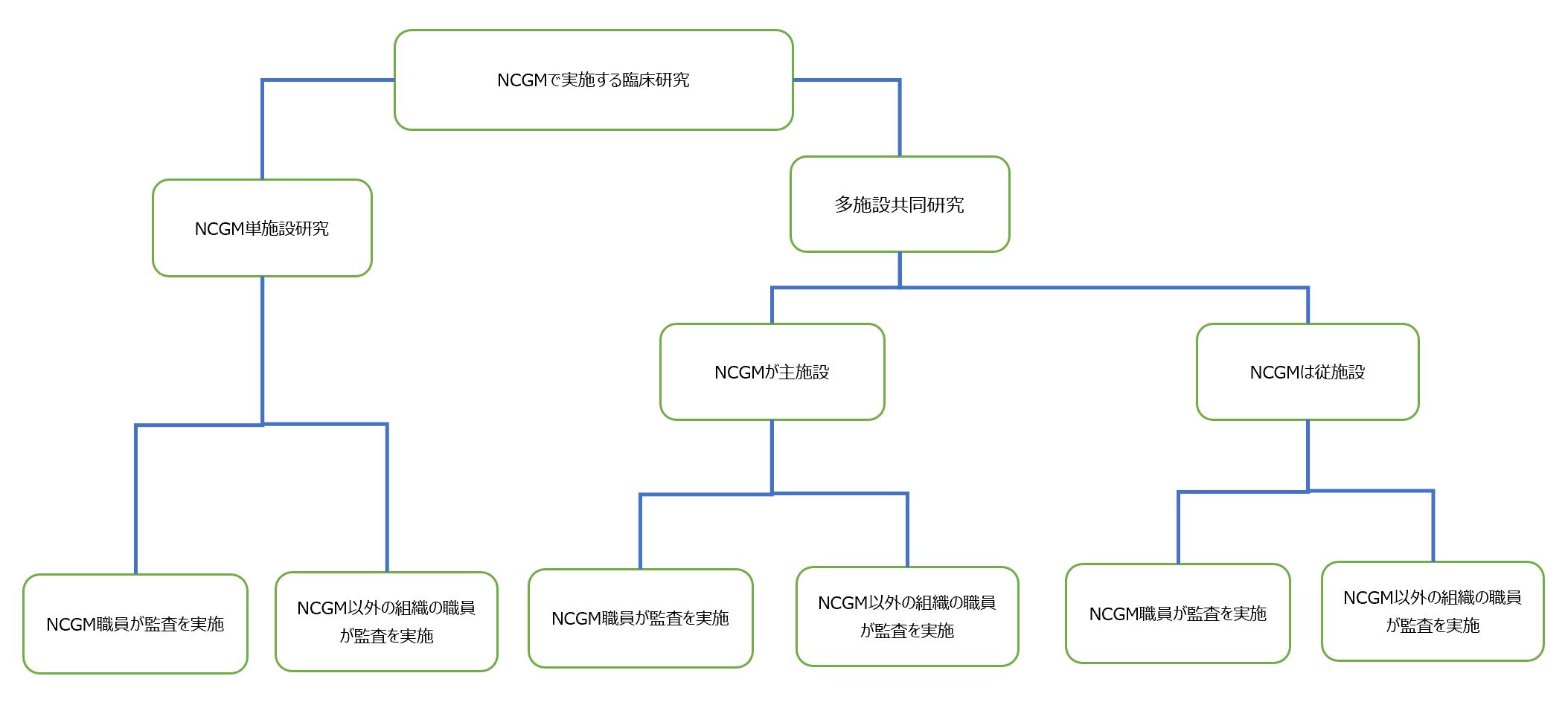
1.NCGMで実施する臨床研究に係る監査の流れは、上に記載する「一般的な監査の流れ」のようになります。
2.NCGM以外の組織(例:CRO,ARO,多施設共同研究の主施設など)の監査担当者による監査を受ける場合の監査の流れは「一般的な監査の流れ」と基本的に同様ですが、監査を受ける際には、これら監査担当者から事前に直接閲覧申込書を提出してもらいます。
直接閲覧受付窓口|臨床研究センター (ncgm.go.jp)
3.監査対象となる臨床研究について、NCGMが多施設共同研究における従施設として参加する場合には、「一般的な監査の流れ」に示した監査の要否判断、監査担当者の指名、監査計画書や監査手順書の作成などに関する研究責任者の役割は主施設の研究責任者が担います。
NCGM職員の方は以下の手順で「モニタリング・監査」を参照し、詳細な手順を確認してください。
- ① NCGM share point > 研究関係 > お知らせ_倫理審査関係(CRB, 倫理審査委員会) > ◆各申請方法リンク_NCGMもしくは他の認定臨床研究審査委員会(CRB)にて審査 > ■臨床研究開始後_モニタリング・監査
- ② NCGM share point > 研究関係 > お知らせ_倫理審査関係(CRB, 倫理審査委員会) > ◆各申請方法リンク_NCGMもしくは他の倫理審査委員会にて審査 > ■臨床研究開始後_モニタリング・監査
【参考】