臨床研究安全管理室
更新日:2024年8月26日
連絡先
SAEreport"AT"hosp.ncgm.go.jp ※"AT"を@に変えてください業務
臨床研究安全管理室では、NCGMで実施中の臨床研究等で生じた有害事象や不適合等に関する研究機関の長及び実施医療機関の長への報告窓口として情報を集約化し、事象の分析及び再発防止策等の適切な処置の検討等を行い、臨床研究の安全確保を図っています。また、臨床研究における安全性報告に関する研究者等からの相談等への対応や啓蒙活動等を通じて、研究者等への支援を行っています。
臨床研究における安全性報告
以下の事案が発生した場合、報告対象と報告期限を確認の上、必要な報告書をダウンロードして、上記連絡先まで提出してください。認定臨床研究審査委員会(CRB)への報告義務のある事象については定められた統一書式を使用し、それ以外はNCGM様式を使用してください。
1. 有害事象(疾病等、感染症含む)又は不具合が発生した場合
侵襲を伴う「人を対象とした生命科学・医学系研究に関する倫理指針」に準拠した臨床研究
<フローチャート>
https://ccs.ncgm.go.jp/110/medical/start/adverse_event_report/
<報告対象>
重篤な有害事象 (Serious Adverse Event: SAE) ※について、研究機関の長(理事長)及び倫理審査委員会へ報告する必要があります。
また、侵襲(軽微な侵襲を除く。)を伴う研究であって介入を伴うものの実施において、当該研究との直接の因果関係が否定できない予測できない重篤な有害事象については、別途厚生労働大臣への報告と公表が必要です。
※:有害事象とは、実施された研究との因果関係の有無を問わず、研究対象者に生じた全ての好ましくない又は意図しない傷病若しくはその徴候(臨床検査値の異常を含む。)をいい、そのうち以下に該当するものを重篤な有害事象といいます。
① 死に至るもの
② 生命を脅かすもの
③ 治療のための入院又は入院期間の延長が必要となるもの
④ 永続的又は顕著な障害・機能不全に陥るもの
⑤ 子孫に先天異常を来すもの
<書式>
NCGM様式 重篤な有害事象の報告書[Word]※
厚労大臣報告用(参考様式3)[Word]
※:研究組織等で規定した書式等がある場合は、他書式での報告可
<SOP>
国立研究開発法人国立国際医療研究センター
人を対象とする生命科学・医学系研究における有害事象又は不具合の報告・対応に係る手順書
臨床研究法に準拠した特定臨床研究等
<フローチャート>
https://ccs.ncgm.go.jp/110/clinical/start/disease_report/
<報告対象>
下表に示す疾病等、感染症又は不具合に該当する場合は、実施医療機関の管理者(病院長)へ報告の上、期限内に当該研究の審査を行った認定臨床研究審査委員会(CRB)への報告が必要です。また、一部厚生労働大臣(PMDA)への報告も期限内に行う必要があります。
この他、NCGMで発生した重篤な有害事象については、NCGM病院長への報告を求めています。
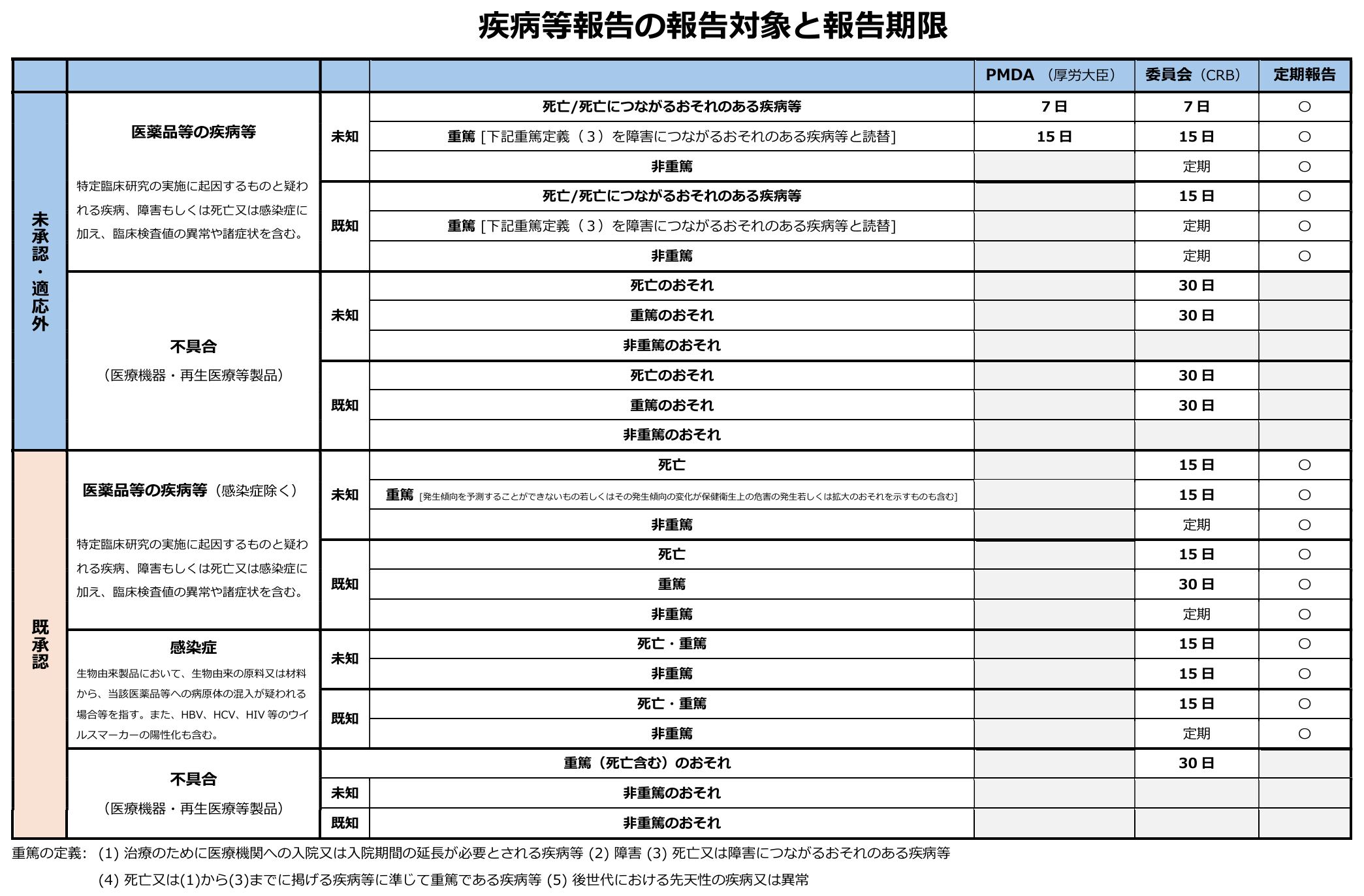
https://www.mhlw.go.jp/content/10800000/000647734.pdf
上記を加工して作成
<書式>
・CRB報告対象の事象は、以下の統一書式をご使用ください。
・厚生労働大臣(PMDA)への疾病等報告は、jRCT(臨床研究等提出・公開システム)の疾病等報告システム※より報告して下さい。
※報告内容登録後、「PMDA にメール送信」ボタン押下時に、入力内容が自動的に厚生労働大臣(PMDA)に送信されます。
※詳細はjRCT操作マニュアル【登録者編】参照。
・上記に該当しないNCGM発生SAE報告等はNCGM様式 重篤な有害事象の報告書[Word]等をご使用ください。
<SOP>
国立研究開発法人国立国際医療研究センター
特定臨床研究等における疾病等及び有害事象又は不具合の報告・対応に係る手順書
2. 不適合が発生した場合
「人を対象とした生命科学・医学系研究に関する倫理指針」に準拠した臨床研究
<フローチャート>
https://ccs.ncgm.go.jp/110/medical/start/nonconformity_report/
<報告対象>
研究で生じた不適合について、研究機関の長(理事長)へ報告の上、不適合の程度が重大であるか否かの判断について、倫理審査委員会の意見を聴く必要があります。
重大な不適合に該当する場合、別途厚生労働大臣への報告と公表が必要です。
<書式>
NCGM様式 不適合の発生に関する報告書[Word] ※
※:研究組織等で規定した書式等がある場合は、他書式での報告可
<SOP>国立研究開発法人国立国際医療研究センター
人を対象とする生命科学・医学系研究における不適合の報告・対応に係る手順書
臨床研究法に準拠した特定臨床研究等
<フローチャート>
https://ccs.ncgm.go.jp/110/clinical/start/nonconformity_report/
<報告対象>
研究で生じた不適合について、実施医療機関の管理者(病院長)への報告が必要です。
また、当該不適合の程度が重大である場合、当該研究の審査を行った認定臨床研究審査委員会(CRB)の意見を聴く他、実施医療機関の管理者から当該重大な不適合に関する対応の状況等を公表する必要があります。
<書式>
CRBへの報告対象となる重大な不適合については統一書式をご使用ください。
上記に該当しない不適合報告については、 NCGM様式 不適合の発生に関する報告書[Word] 等をご使用ください。
<SOP>
国立研究開発法人国立国際医療研究センター
特定臨床研究等における不適合の報告・対応に係る手順書