対象とする医薬品・医療機器
日本では質の高い医薬品・医療機器が開発されていますが、それらの有用性にも関わらず、市場が国内に限られているケースが多いのが現実です。私たちはこれら医薬品がグローバルに展開されるようになれば世界中の利益につながると考えています。日本において発症は低いものの、諸外国においては大きな医療上の問題となっている感染症であるマラリア、デング熱、B型肝炎など、開発中もしくは承認されているものの、海外では未承認の医薬品、体外診断用医薬品、医療機器、予防薬などの開発を支援します。
治療薬の適用拡大
日本において特定の疾患の治療薬として既に承認されていて、他の疾患においても効果が期待されるものがあります。これらに関しては臨床研究によって十分なエビデンスを蓄積することが不可欠です。
当該国における薬事承認
医療品の薬事規制は国によって異なります。時には十分なエビデンスを提示するためにブリッジング試験(海外の試験データを国内の試験データに追加・代用する)や追加の研究が求められます。
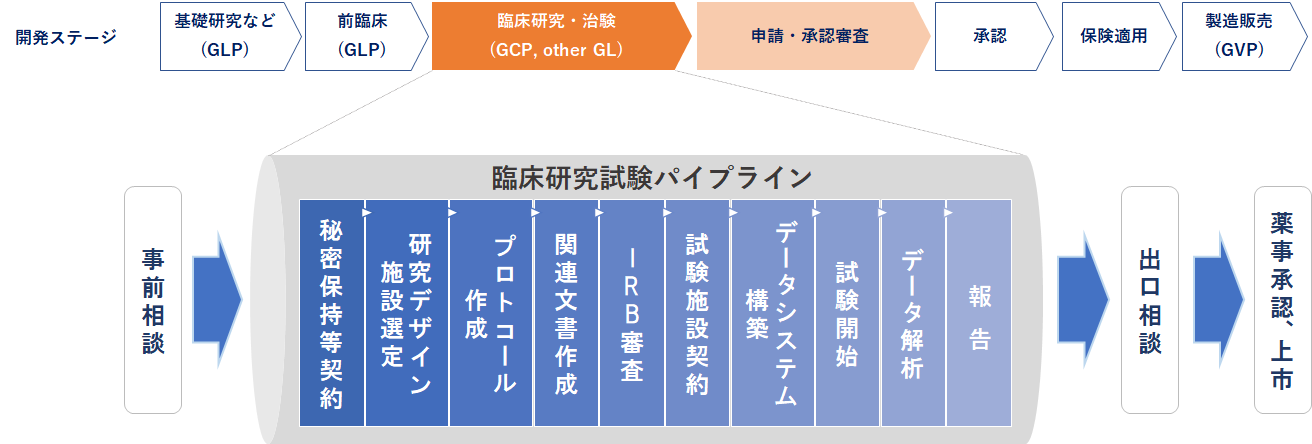
国際臨床研究・試験の実施・支援
事前相談で、対象製品の海外展開や国際臨床研究・試験への適合性を判断した後、国際臨床研究・試験の実施に向けて支援します。